Hoe werkt het periodiek systeem?
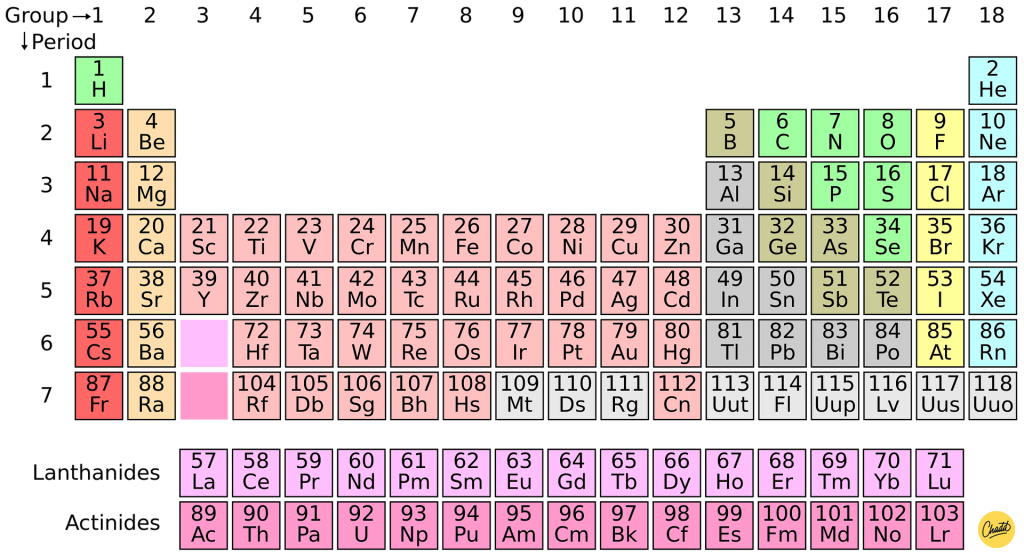
Het periodiek systeem der elementen is een tabel met alle chemische elementen.
In de tabel staan de elementen en hun atoomnummers. In het periodiek systeem staan gegevens die je kunt gebruiken bij het doen van berekeningen.
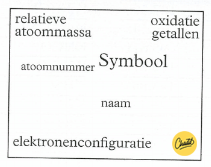
Je kunt het atoomnummer, massagetal en de elektronenconfiguratie vinden.
De elementen die veel op elkaar lijken staan dicht bij elkaar. Het periodiek systeem heeft groepen en rijen.
Groepen
De groepen zijn de verticale kolommen, daar zijn er 18 van. De elementen die in dezelfde groep staan zijn verwant aan elkaar, ze hebben eigenschappen die overeenkomen. Sommige groepen hebben een naam, bijvoorbeeld in groep 17 zitten de halogenen en in groep 18 zitten de edelgassen.
Perioden
De perioden zijn de horizontale rijen, daar zijn er 7 van. Het nummer van de periode is hetzelfde als het aantal schillen dat een atoom gebruikt. Dat zijn het aantal banen om de atoomkern heen waarin elektronen zweven. In de perioden lopen de atoomnummers op.

In sommige periodieke systemen zijn elementen gekleurd, de gekleurde groepen kunnen aangeven wat voor soort element het is. Bijvoorbeeld niet-metalen (rood) of metalen (geel). Het periodiek systeem kun je vinden in tabel 99 van de Binas.
Covalentie
De covalentie van een atoom bepaald met hoeveel atomen hij een binding aan kan gaan. De covalentie hangt af van het aantal vrije elektronen in de buitenste schil. Om het aantal vrije elektronen te bepalen kun je gebruik maken van de octetregel gebruiken. Met de octetregel wordt aangegeven dat in de buitenste schil van een edelgas acht elektronen zitten waardoor er een stabiele elektronen omringing optreed. In de buitenste ring moeten dus minstens acht elektronen zitten. In de Binas kun je rechts onderin bij de elementen zien hoeveel elektronen er in de schil zitten.
Als voorbeeld bekijken we fosfor. In de Binas kun je zien dat de elektronenconfiguratie 2,8,5 is. In de buitenste schil zitten dus vijf elektronen, 8-5=3 dus er moeten nog drie elektronen bij om er acht te krijgen. Fosfor heeft dus een covalentie van drie.
Vraag
Hoe bepaal je de covalentie van zwavel?
Loop je nog steeds vast bij Scheikunde? Dan kan bijles heel handig zijn!
Leerlingen die hier vragen over hebben, keken ook naar:
Werkt u in het vo of mbo? Plan direct een vrijblijvende demonstratie in!
We laten u graag geheel vrijblijvend zien hoe Mr. Chadd werkt, hoe het kan worden ingezet en wat de meerwaarde is. Dit doen we in een fysieke of online afspraak van zo'n 30 minuten. Let op! Deze demonstratie is alleen bedoeld voor mensen die werkzaam zijn in het vo of mbo, NIET voor leerlingen!

Meer informatie over Mr. Chadd
Laat hieronder uw gegevens achter en we sturen u geheel vrijblijvend meer informatie over Mr. Chadd op!

Werkt u in het vo of mbo? Neem contact op!
Bent u benieuwd naar de voordelen van Mr. Chadd of heeft u andere vragen? Laat uw gegevens achter en wij nemen zo snel mogelijk contact op.


