Polaire en apolaire moleculen
Moleculen hebben nooit een negatieve of een positieve lading, de lading is in totaal altijd 0.
Soms is de lading binnen het molecuul niet helemaal gelijk verdeeld. Eén kant van het molecuul heeft een positieve lading en de andere kant van een molecuul heeft een negatieve lading. Het verschil in lading is niet heel groot, maar er kunnen wel bindingen tussen verschillende moleculen door ontstaan. Dit kun je o.a. lezen in ons artikel over Vanderwaalskrachten. Moleculen die een verschil in lading hebben noemen we polaire moleculen. Moleculen die geen verschil in lading hebben noemen we apolaire moleculen.
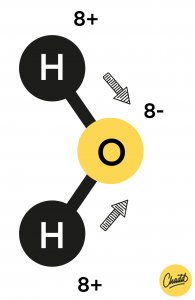
De lading in een polair molecuul geven we aan met de griekse letter delta 𝛿 en een + of – teken. Moleculen die een polair zijn hebben een dipoolmoment en ze kunnen een dipool-binding aangaan.
Polariteit ontstaat doordat de kern van het ene atoom hard trekt aan de elektronen van het ander atoom. De landingen binnen het atooom veranderen daardoor een beetje. Bij water trekt het zuurstofatoom hard aan de elektronen van de waterstofatomen. De waterstofatomen worden daardoor positiever en het zuurstofatoom wordt dan negatiever.

De polariteit van moleculen kun je bepalen door naar de ruimtelijke structuur te kijken. Als moleculen symmetrisch zijn worden de ladingen onderling opgeheven. Het molecuul is dan apolair. Als een molecuul niet symmetrisch is worden de ladingen niet opgeheven en krijg je een polair molecuul.
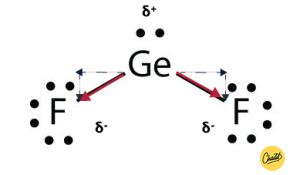
Dit molecuul is niet symmetrisch, er wordt niet overal even hard getrokken aan het Ge-atoom. Hierdoor kan er een verschil in lading ontstaan tussen de F-atomen en het Ge-atoom en is er spaken van polariteit.
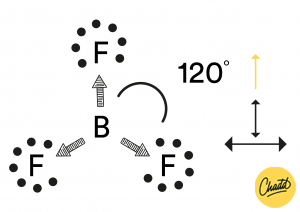
Bij dit molecuul is er wel symmetrie. Van alle kanten wordt aan het B-atoom getrokken. De F-atomen trekken allemaal even hard. Hierdoor is er geen verschil in lading en is er dus een apolair molecuul.
Oefenvragen
- Is methaan ( CH 4 ) een polair of een apolair molecuul?
- Is trichloormethaan ( CHCl 3 ) een polair of een apolair molecuul?
Antwoorden
-
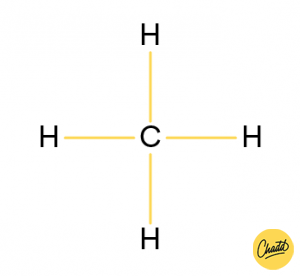
- Teken eerst de structuurformule van methaan. Je kan zien dat er symmetrie is. Aan alle kanten van het C-atoom zit een H-atoom. Dit is dus een apolair molecuul.
-
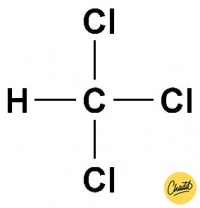
- Teken eerst de structuurformule van trichloormethaan. Je kan zien dat er aan drie kanten Cl zit en aan één kant H. Er is dus geen symmetrie en dit molecuul is dus polair.
Leerlingen die hier vragen over hebben, keken ook naar:
Werkt u in het vo of mbo? Plan direct een vrijblijvende demonstratie in!
We laten u graag geheel vrijblijvend zien hoe Mr. Chadd werkt, hoe het kan worden ingezet en wat de meerwaarde is. Dit doen we in een fysieke of online afspraak van zo'n 30 minuten. Let op! Deze demonstratie is alleen bedoeld voor mensen die werkzaam zijn in het vo of mbo, NIET voor leerlingen!

Meer informatie over Mr. Chadd
Laat hieronder uw gegevens achter en we sturen u geheel vrijblijvend meer informatie over Mr. Chadd op!

Werkt u in het vo of mbo? Neem contact op!
Bent u benieuwd naar de voordelen van Mr. Chadd of heeft u andere vragen? Laat uw gegevens achter en wij nemen zo snel mogelijk contact op.

