Hoe werken vanderwaalsbindingen?
Een vanderwaalsbinding is een binding tussen twee moleculen.
Vanderwaalsbindingen zijn zwakke bindingen, ze kunnen makkelijk verbroken worden.
Let op: vanderwaalsbindingen zijn geen covalente bindingen, de moleculen worden dus niet samengevoegd tot één molecuul. Vanderwaalsbindingen ontstaan door vanderwaalskrachten. Er zijn drie soorten vanderwaalskrachten.

Dipool-dipool interactie
In een molecuul is de lading niet altijd gelijk verdeeld, daardoor ontstaat er een positieve en een negatieve kant. Een atoom met een negatieve lading en een atoom met een positieve lading van een ander molecuul trekken elkaar aan. Er ontstaat dan een dipool-dipool binding, dat is een vorm van vanderwaalsbinding. Een dipool-dipool interactie vindt plaats tussen twee moleculen met een permanent dipoolmoment. De moleculen hebben dus altijd een positieve en een negatieve kant. Wil je meer weten over polariteit? Kijk dan even bij dit artikeltje !
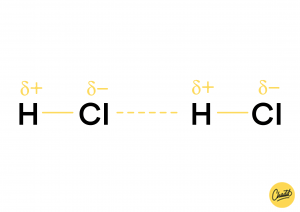
Geïnduceerde dipool-dipoolinteractie
Er zijn moleculen met een permanent dipoolmoment en er zijn polariseerbare moleculen. Polariseerbare moleculen kunnen door een kracht van buitenaf een dipoolmoment krijgen. Een geïnduceerde dipool-dipool interactie vindt plaats tussen een molecuul met een permanent dipoolmoment en een polariseerbaar molecuul. Het molecuul met een permanent dipoolmoment is de kracht van buitenaf die het polariseerbare molecuul polariseert. Beide moleculen hebben dan een positieve en een negatieve kant, zo kan er een binding ontstaan.
Londonkracht
Londonkrachten zijn krachten tussen apolaire moleculen. Apolaire moleculen hebben normaal gesproken geen polariteit en dus ook geen dipoolmoment. Soms hebben apolaire moleculen een tijdelijk dipoolmoment. Als twee apolaire moleculen een tijdelijk dipoolmoment hebben binden ze aan elkaar.
Leerlingen die hier vragen over hebben, keken ook naar:
Werkt u in het vo of mbo? Plan direct een vrijblijvende demonstratie in!
We laten u graag geheel vrijblijvend zien hoe Mr. Chadd werkt, hoe het kan worden ingezet en wat de meerwaarde is. Dit doen we in een fysieke of online afspraak van zo'n 30 minuten. Let op! Deze demonstratie is alleen bedoeld voor mensen die werkzaam zijn in het vo of mbo, NIET voor leerlingen!

Meer informatie over Mr. Chadd
Laat hieronder uw gegevens achter en we sturen u geheel vrijblijvend meer informatie over Mr. Chadd op!

Werkt u in het vo of mbo? Neem contact op!
Bent u benieuwd naar de voordelen van Mr. Chadd of heeft u andere vragen? Laat uw gegevens achter en wij nemen zo snel mogelijk contact op.

