Dipool-dipool interactie
Dipool-dipool interactie en geïnduceerde dipool-dipool interacties zijn Vanderwaalsbindingen.
Wil je meer weten over Vanderwaalsbindingen? Kijk dan even in dit artikel.
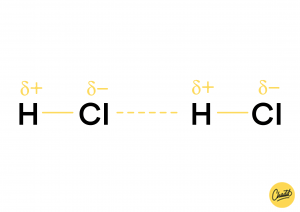
Dipool-dipool interactie
In een molecuul is de lading niet altijd gelijk verdeeld, daardoor ontstaat er een kant met een kleine positieve lading en een kant met een kleine negatieve lading (δ+ en de δ−), dat heet polariteit. Wil je meer weten over polariteit? Kijk dan even in dit artikel.
Een molecuul heeft alleen een dipoolmoment wanneer het verschil tussen de elektronegativiteit van de atomen van het molecuul tussen de 0,4 en 1,6 ligt. Daarnaast moeten de atomen waar lading ligt gescheiden zijn en elkaar niet opheffen. Neem bijvoorbeeld H2O: het is geen lineair molecuul, maar een soort van Mickey Mouse-hoofd, dus valt de lading (δ+ van de waterstofmoleculen en de δ− van zuurstof) niet samen. CO2 is een lineair molecuul, dus de δ+ van het koolstofatoom valt samen met de δ− van de beide zuurstofatomen, en daarom is CO2 geen dipoolmolecuul. Een atoom met een negatieve lading en een atoom met een positieve lading van een ander molecuul trekken elkaar aan. Denk maar aan een magneet, die noordpool van de ene magneet trekt de zuidpool van de andere magneet aan. Dat gebeurt ook bij dipool-dipool interactie, er ontstaat dan een dipool-dipool binding. Een dipool-dipool interactie vindt plaats tussen twee moleculen met een permanent dipoolmoment. De moleculen hebben dus altijd een positieve en een negatieve kant.
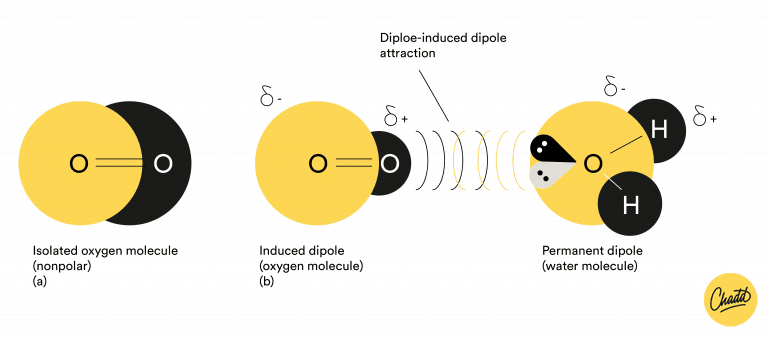
Geïnduceerde dipool-dipoolinteractie
Er zijn moleculen met een permanent dipoolmoment en er zijn polariseerbare moleculen. Polariseerbare moleculen hebben niet altijd een dipoolmoment maar ze kunnen door een kracht van buitenaf een dipoolmoment krijgen. Een geïnduceerde dipool-dipool interactie vindt plaats tussen een molecuul met een permanent dipoolmoment en een polariseerbaar molecuul. Het molecuul met een permanent dipoolmoment is de kracht van buitenaf die het polariseerbare molecuul polariseert. Het molecuul met een permanent dipoolmoment trekt dan zo had aan het andere molecuul dat die een geïnduceerd dipoolmoment krijgt. Beide moleculen hebben dan een positieve en een negatieve kant, zo kan er een binding ontstaan.
Opdrachten
Is CH4 een dipoolmolecuul? Teken het molecuul uit, geef de atomen de juiste lading en laat zien waarom wel/niet.
Is HCl een dipoolmolecuul? Teken het molecuul uit, geef de atomen de juiste lading en laat zien waarom wel/niet.
Leerlingen die hier vragen over hebben, keken ook naar:
Werkt u in het vo of mbo? Plan direct een vrijblijvende demonstratie in!
We laten u graag geheel vrijblijvend zien hoe Mr. Chadd werkt, hoe het kan worden ingezet en wat de meerwaarde is. Dit doen we in een fysieke of online afspraak van zo'n 30 minuten. Let op! Deze demonstratie is alleen bedoeld voor mensen die werkzaam zijn in het vo of mbo, NIET voor leerlingen!

Meer informatie over Mr. Chadd
Laat hieronder uw gegevens achter en we sturen u geheel vrijblijvend meer informatie over Mr. Chadd op!

Werkt u in het vo of mbo? Neem contact op!
Bent u benieuwd naar de voordelen van Mr. Chadd of heeft u andere vragen? Laat uw gegevens achter en wij nemen zo snel mogelijk contact op.

