Wat is een evenwichtsreactie en hoe werkt het?
Een evenwichtsreactie is een reactie die twee kanten op werkt.
Zulke reacties eindigen niet, zoals bij verbranding wel gebeurt, maar blijven reageren.
Na een bepaalde tijd bereiken deze reacties een bepaald evenwicht, waarin de concentraties van de stoffen constant blijven.

Een bekend voorbeeld van een evenwichtsreactie is de volgende reactievergelijking:
3 H2(g) + N2(g) ↔ 2 NH3(g)
Zoals je ziet heeft deze reactievergelijking een dubbele pijl. Dat betekent dat er twee reacties voorkomen: de vorming van ammoniak door waterstof en stikstof en de omgekeerde reactie.
Wat heb je nodig voor een evenwichtsreactie?
Een evenwichtsreactie kan alleen plaatsvinden met vloeistoffen of gassen. Hierdoor is er een bepaalde molariteit (dus een bepaald aantal mol per liter) van elke stof aanwezig die wordt gebruikt om het evenwicht te vormen.
Daarnaast vinden evenwichtsreacties alleen in gesloten ruimtes plaats. Als dit niet het geval is, dan kunnen de verschillende stoffen gemakkelijk verspreiden, waardoor ze niet meer met elkaar reageren.
Evenwichtsconstante
De evenwichtsconstante (K) van een reactie geeft aan in welke verhouding de verschillende stoffen aanwezig zijn in een evenwicht. Je kunt een aantal evenwichtsconstanten vinden in tabel 49 t/m 51 van je BiNaS. Bij de reactie met ammoniak bijvoorbeeld is de evenwichtsconstante bij kamertemperatuur 6,8*105. De evenwichtsconstante is gelijk aan de concentratiebreuk. Je kunt de concentratiebreuk van een bepaalde reactie op de volgende manier vinden.
Als je reactievergelijking er zo uitziet:
m A + n B ↔ q C + r D
Dan wordt de concentratiebreuk:
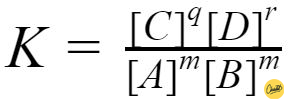
De coëfficiënten van de stoffen in de reactievergelijking (hoe vaak een stof voorkomt), die komen dus als macht terug in de concentratiebreuk.
In het geval van ammoniak komt de concentratiebreuk er dan zo uit te zien:
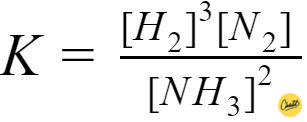
BOE-schema
Als je moet rekenen met evenwichtsreacties, dan is het handig om een BOE-schema te maken. Zo’n schema geeft de concentraties weer in het begin, in de omzetting en aan het einde.
Voorbeeld:
Er wordt 2 mol NH3 in een vat van 1,0 dm3 gestopt. Stel een BOE-schema op.
In het begin is er alleen 2 mol NH3 aanwezig. In de omzetting verdwijnt er NH3 en komt er H2 en N2 bij. Je kunt zien hoeveel er bij komt door naar de verhoudingen in de reactievergelijking. Als er 2 mol NH3 verdwijnt, dan komt er 3 mol H2 en 1 mol N2 bij. We weten niet precies hoeveel stof er ontstaan is of verdwenen is, alleen de verhouding. Daarom noemen we dit x. De eindhoeveelheid bereken je dan door de hoeveelheid van het begin op te tellen bij hoeveel er bijkomt of afgaat in de omzetting. Het BOE-schema komt er dan zo uit te zien:
| NH3 | H2 | N2 | |
|---|---|---|---|
| Begin | 2 | 0 | 0 |
| Omzetting | -2x | +3x | +x |
| Eind | 2-2x | 3x | x |
Vervolgens kun je de concentraties uit de eindtoestand invullen in de concentratiebreuk. Vervolgens kun je met de abc-formule oplossen hoeveel stof er in de overgangsfase is verdwenen of bijgekomen. Dit ziet er als volgt uit:
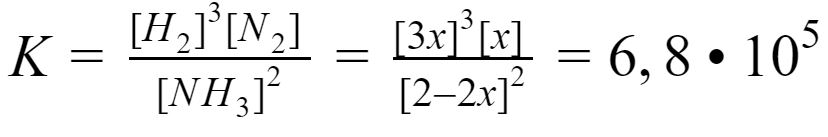
Leerlingen die hier vragen over hebben, keken ook naar:
Hoe bereken je de concentratie van een oplossing?
Werkt u in het vo of mbo? Plan direct een vrijblijvende demonstratie in!
We laten u graag geheel vrijblijvend zien hoe Mr. Chadd werkt, hoe het kan worden ingezet en wat de meerwaarde is. Dit doen we in een fysieke of online afspraak van zo'n 30 minuten. Let op! Deze demonstratie is alleen bedoeld voor mensen die werkzaam zijn in het vo of mbo, NIET voor leerlingen!

Meer informatie over Mr. Chadd
Laat hieronder uw gegevens achter en we sturen u geheel vrijblijvend meer informatie over Mr. Chadd op!

Werkt u in het vo of mbo? Neem contact op!
Bent u benieuwd naar de voordelen van Mr. Chadd of heeft u andere vragen? Laat uw gegevens achter en wij nemen zo snel mogelijk contact op.


