Hoe werken zuur-base reacties?
Een zuur-base reactie is een reactie tussen een zuur en een base.
Een zuur is een stof die een H+ ion kan afstaan, een base is een stof die een H+ kan opnemen.
Een H+ ion wordt ook wel een proton genoemd, een zuur is dus een protondonor en een base een proton acceptor.
Een zuur-base koppel is een zuur en een base die door het overgeven van één proton in elkaar over kunnen gaan: zuur ↔ base +H+

Er zijn twee soorten zuur-base reacties, niet-evenwichtsreacties en evenwichtsreacties.
Niet-evenwichtsreacties
Bij een niet-evenwichtsreactie is er sprake van een aflopende reactie. Dit gebeurt alleen bij een sterk zuur of een sterke base. Het zuur splitst volledig in water, het geeft alle H+ ionen af. Bijvoorbeeld bij salpeterzuur: HNO3(aq) + H2O→ H3O+ + (aq) + NO3–(aq).
Evenwichtsreacties
Bij evenwichtsreacties splitst een zuur zich niet volledig, er ontstaat dan een evenwicht. Een evenwichtsreactie vindt plaats bij een zwak zuur of een zwakke base. Bijvoorbeeld: HF (aq) + H**2**O (l) H**3**O+ (aq) +F–(aq). Waterstoffluoride (HF) met water (*H2O*) kan een hydroxonium-ion (H**3**O+) en fluoride (F–) vormen, omgekeerd gebeurt ook een hydroxonium-ion (H3O+) en fluoride (F**-**) vormen waterstoffluoride (HF) en water (H**2**O).
pH
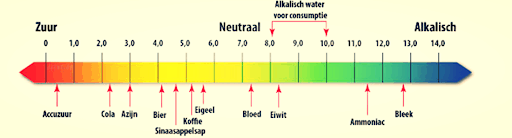
Met de pH, of zuurgraad, wordt aangegeven hoe zuur of basische een oplossing is. De pH loopt van 0, heel zuur, tot 14, heel basisch. Als de pH lager is dan 7 is een oplossing zuur, als de pH hoger is dan 7 is een oplossing basisch. Als een stof een pH heeft van 7,0 is de oplossing neutraal.
De pH kun je ook berekenen als de de concentratie H+ionen weet. Je kan dan de volgende formule gebruiken:
pH = -log[H+].
Je kan ook de concentratie H+ ionen berekenen als je de pH weet. Je gebruikt dan de formule: [H+] =10-pH
De vierkante haakjes, [ ], betekent dat je de concentratie in moet vullen van het ion.
pOH
De pOH is precies het tegenovergestelde van de pH. Met de pOH kun je de hoeveelheid OH– ionen berekenen. Voor de pH en de pOH geldt: pH + pOH = 14. Als je de pOH kunt berekenen kun je dus de pH bepalen.
De pOH kun je ook berekenen als de de concentratie OH-ionen weet. Je kan dan de volgende formule gebruiken:
pOH = -log[OH–].
Oefenvragen
- Wat is de pH bij een concentratie van 0,10 mol H+?
- Wat is de concentratie H+ bij een pH van 4?
- Wat is de pH bij een concentratie van 0,10 mol OH**–**?
Leerlingen die hier vragen over hebben, keken ook naar:
Zuren en basen: wat zijn het? En hoe bereken je de pH?
Werkt u in het vo of mbo? Plan direct een vrijblijvende demonstratie in!
We laten u graag geheel vrijblijvend zien hoe Mr. Chadd werkt, hoe het kan worden ingezet en wat de meerwaarde is. Dit doen we in een fysieke of online afspraak van zo'n 30 minuten. Let op! Deze demonstratie is alleen bedoeld voor mensen die werkzaam zijn in het vo of mbo, NIET voor leerlingen!

Meer informatie over Mr. Chadd
Laat hieronder uw gegevens achter en we sturen u geheel vrijblijvend meer informatie over Mr. Chadd op!

Werkt u in het vo of mbo? Neem contact op!
Bent u benieuwd naar de voordelen van Mr. Chadd of heeft u andere vragen? Laat uw gegevens achter en wij nemen zo snel mogelijk contact op.


