Rekenen met mol: wat is mol en hoe kun je hier mee rekenen?
Mol is een begrip dat je heel vaak tegenkomt bij scheikunde.
We gebruiken mol, zodat we kunnen zien in welke verhouding stoffen voorkomen.
Maar wat is het precies en hoe kun je hier het makkelijkste mee rekenen?

Wat is mol?
Het aantal mol van een bepaalde stof, zegt iets over de hoeveelheid deeltjes waaruit een bepaalde stof, zoals koolstof (C) of zuurstof (O), bestaat. Alle verschillende stoffen hebben een bepaalde massa per mol. Dit wordt de molaire massa genoemd. De molaire massa van zuurstof is bijvoorbeeld 16,0 gram per mol. Dat betekent dat 1 mol zuurstof 16,0 gram weegt. De molaire massa kun je in het periodiek systeem (tabel 99 in je BiNaS) opzoeken. Vanuit mol kun je het volume en de massa van een bepaalde stof berekenen.
Zo werkt de app
Mol en massa
Als je het aantal mol van een stof weet en je wil weten wat de massa is, dan gebruik je hiervoor de molaire massa (in g/mol). Dit kun je vinden in tabel 99 in BiNaS. Je gaat van mol naar massa door het aantal mol te vermenigvuldigen met de molaire massa.
Als je de massa van een stof weet en je wil het aantal mol weten, dan doe je het tegenovergestelde, dus dan deel je door de molaire massa.
Voorbeeld:
Je hebt 32 gram zuurstof. Hoeveel mol is dat?
In tabel 99 van je BiNaS kun je vinden dat de molaire massa van zuurstof 16,0 g/mol is. Je kunt het aantal mol uitrekenen door het aantal gram te delen door de molaire massa. Dan krijg je dus:
32 g/16,0 g/mol = 2 mol zuurstof.
Mol en volume van een vloeistof
Als je het aantal mol van een stof weet en je wil weten hoeveel liter je hebt, heb je hier de molariteit voor nodig. De eenheid van molariteit is mol/L of M. Deze eenheid wordt gegeven in de opdracht. Je kunt van mol naar volume gaan door het aantal mol te delen door de molariteit.
Als je het volume weet en je wil het aantal mol weten, dan vermenigvuldig je het volume met de molariteit.
Voorbeeld:
Je hebt 5 L zoutzuur met een molariteit van 0,1 mol/L. Hoeveel mol zoutzuur heb je?
We kunnen van volume naar mol gaan door het volume te vermenigvuldigen met de molariteit. In dit geval wordt dat dan: 5 L x 0,1 mol/L = 0,5 mol zoutzuur.
Mol en volume van een gas
Als je het aantal mol van een stof weet en je wil weten wat de massa is, dan gebruik je hiervoor het molair volume (in m3/mol). Dit kun je vinden in tabel 7 in BiNaS. Bij kamertemperatuur is dit 2,45 x 10-2 m3/mol. Je gaat van mol naar volume door het aantal mol te vermenigvuldigen met het molair volume.
Als je het volume van een stof weet en je wil het aantal mol weten, dan doe je het tegenovergestelde, dus dan deel je door het molair volume.
Voorbeeld:
Je hebt 32 mol zuurstof op kamertemperatuur. Hoeveel m3 is dat?
Hieronder vind je een overzicht met wat je precies moet doen om van de ene eenheid naar de andere te gaan.
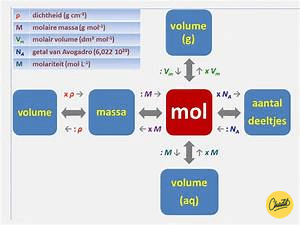
Aanpak bij opdrachten met mol
Veel opdrachten waar je mol bij nodig hebt kun je op dezelfde manier aanpakken. Hieronder volgt een stappenplan hoe je dit het beste kunt doen.
- Schrijf de reactievergelijking op.
- Reken de gegevens om naar mol.
- Schrijf de molverhouding op.
- Bereken het aantal gevraagde stof met behulp van de molverhouding.
- Reken dit om naar de gevraagde hoeveelheid.
Leerlingen die hier vragen over hebben, keken ook naar:
Werkt u in het vo of mbo? Plan direct een vrijblijvende demonstratie in!
We laten u graag geheel vrijblijvend zien hoe Mr. Chadd werkt, hoe het kan worden ingezet en wat de meerwaarde is. Dit doen we in een fysieke of online afspraak van zo'n 30 minuten. Let op! Deze demonstratie is alleen bedoeld voor mensen die werkzaam zijn in het vo of mbo, NIET voor leerlingen!

Meer informatie over Mr. Chadd
Laat hieronder uw gegevens achter en we sturen u geheel vrijblijvend meer informatie over Mr. Chadd op!

Werkt u in het vo of mbo? Neem contact op!
Bent u benieuwd naar de voordelen van Mr. Chadd of heeft u andere vragen? Laat uw gegevens achter en wij nemen zo snel mogelijk contact op.


