Scheidingsmethoden: wat zijn het en welke scheidingsmethoden zijn er?
Hoe kunnen we stoffen weer van elkaar scheiden? Welke scheidingsmethoden kunnen we hiervoor gebruiken, en waarop berust hun werking?
Lees snel verder voor alle antwoorden en meer handige tips!
Scheidingsmethoden zijn manieren om stoffen weer van elkaar te kunnen scheiden. De werking berust op het gebruik maken van de verschillen in stofeigenschappen van de bestanddelen. Afhankelijk van de oplossing/het mengsel wat gescheiden moet worden, zijn er verschillende scheidingsmethoden.
Adsorberen
Bij deze scheidingsmethode voeg je een adsorptiemiddel aan de oplossing toe te voegen. De opgeloste stof wordt dan opgenomen door het adsorptiemiddel, door hieraan te kleven. Het oplosmiddel hoeft dus niet verwijderd/verdampt te worden. Actieve kool (Norit) is een voorbeeld van een veelgebruikt absorptiemiddel. Scheiding van stoffen door middel van adsorptie gebeurt bijvoorbeeld bij gasmaskers: de giftige stof wordt geadsorbeerd en de schone lucht kan daarna gewoon ingeademd worden.
Bezinken/afschenken
Bezinken/afschenken wordt gebruikt voor mengsels die niet goed in elkaar oplossen (gebrek aan oplosbaarheid) en het gegeven dat één van de stoffen naar de bodem zakt (verschil in dichtheid). Dit kan dus gedaan worden bij emulsies of suspensies: de vaste stof is naar de bodem gezakt (bezonken). De vloeistof kan dan worden afgeschonken. Een voorbeeld is kalkwater (kalkpoeder in water).
Centrifugeren
Deze scheidingsmethode berust op scheiden op basis van een verschil in dichtheid. Bij centrifugeren wordt het mengsel heel snel rondgedraaid, waardoor de zwaardere deeltjes naar buiten worden geslingerd. De stof met de grootste dichtheid bevindt zich dan op de bodem. Dit wordt bijvoorbeeld gedaan bij het scheiden van bloed.
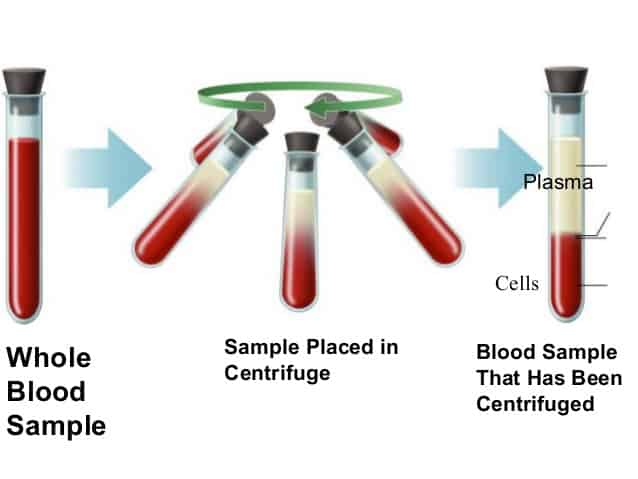
(Bron: https://infograph.venngage.com/p/98238/centrifuge-ahmad-shafeeq)
Destilleren
Bij destilleren worden de stoffen gescheiden doordat de stoffen een verschil in kookpunt hebben. De vloeistof die achterblijft heet residu. De stof die gedestilleerd wordt kan opgevangen worden (doordat de stof weer afkoelt) en dit noemen we het destillaat. Dit doe je bijvoorbeeld wanneer je zeewater kookt om zoet water te krijgen: het water verdampt en kan opgevangen worden. Het destillaat is dan zoet water. Het zout blijft achter en heet het residu.
Filtreren
Bij deze scheidingsmethode wordt gebruik gemaakt van het verschil in deeltjesgrootte tussen twee stoffen door gebruik te maken van een filter. Suspensies kunnen gescheiden worden door filtratie: de deeltjes waar de vaste stof uit bestaat is groter dan de deeltjes waaruit de vloeistof bestaat. De vloeistof die door het filter gaat heet het filtraat. Datgene wat achterblijft in het filter heet het residu.
Extraheren
Bij extraheren worden smaak-, geur- of kleurstoffen aan een andere stof onttrokken. Dit berust op een verschil in oplosbaarheid van twee vaste stoffen in een vloeistof. Een goed voorbeeld hiervan is koffie. De smaak-, geur, en kleurstoffen worden aan de koffiebonen onttrokken door het water (de smaak-, geur-, en kleurstoffen lossen wel op in water, de koffiebonen zelf niet). Er ontstaat dan een mengsel wat vervolgens gefiltreerd wordt (zie ‘Filtreren’). De opgeloste stof gaat wel door het filter heen en noemen we extract. De onopgeloste stof (de koffiebonen zelf) blijft achter in het filter. Dit noemen we het residu.
Indampen
Bij indampen wordt gebruik gemaakt van het verschil in kookpunt. De oplossing wordt verwarmd, totdat het oplosmiddel verdampt is. Ook hier kunnen we het voorbeeld van zout water weer gebruiken, maar nu dampen we de oplossing in omdat we graag zout willen hebben: het water verdampt, waardoor het zout overblijft.
Chromatograferen
Chromatografie berust op de oplosbaarheid van de stoffen die je wilt onderzoeken en de mate waarin deze stoffen kunnen aanhechten aan andere materialen. Bij chromatografie heb je 2 fases. De stationaire fase is de vaste stof of vloeistof waar de stoffen zich aan kunnen vasthechten. De mobiele fase is het gas of de vloeistof die langs de stationaire fase beweegt. Er zijn 2 vormen van chromatografie: vloeistofchromatografie en gaschromatografie. Bij vloeistofchromatografie wordt een vloeistof gebruikt als mobiele fase en bij gaschromatografie een gas. De ene stof gaat meer mee met de mobiele fase en de andere hecht beter aan de stationaire fase. Hierdoor komt de ene stof verder op het papier uit dan de ander.
Leerlingen die hier vragen over hebben, keken ook naar:
Wat zijn mengsels, oplossingen, emulsies, suspensies en de verschillen hiertussen?
Werkt u in het vo of mbo? Plan direct een vrijblijvende demonstratie in!
We laten u graag geheel vrijblijvend zien hoe Mr. Chadd werkt, hoe het kan worden ingezet en wat de meerwaarde is. Dit doen we in een fysieke of online afspraak van zo'n 30 minuten. Let op! Deze demonstratie is alleen bedoeld voor mensen die werkzaam zijn in het vo of mbo, NIET voor leerlingen!

Meer informatie over Mr. Chadd
Laat hieronder uw gegevens achter en we sturen u geheel vrijblijvend meer informatie over Mr. Chadd op!

Werkt u in het vo of mbo? Neem contact op!
Bent u benieuwd naar de voordelen van Mr. Chadd of heeft u andere vragen? Laat uw gegevens achter en wij nemen zo snel mogelijk contact op.


