Koolwaterstoffen
Koolwaterstoffen bevatten de elementen koolstof (C) en waterstof (H).
Deze C- en H-atomen kunnen verschillend aan elkaar verbonden zijn, wat verschillende “deel-families” kan geven.
Deze families noemen we ook wel homologe reeksen . Zo’n reeks van een groep stoffen hebben vergelijkbare chemische eigenschappen en een eigen algemene formule.

Alle koolwaterstoffen hebben we ingedeeld in 2 groepen: aromatische en niet-aromatische koolwaterstoffen. De niet-aromatische koolwaterstoffen noemen we ook wel alifatische koolwaterstoffen . Deze groep kunnen we nog onderverdelen in verzadigd en onverzadigd. Als alle koolstofatomen het maximale aantal waterstoffen gebonden heeft, dan noemen we deze stof verzadigd. Dit geldt voor alle alkanen omdat er geen dubbele of driedubbele bindingen voorkomen. Echter, als er wel van dat soort dubbele bindingen in de structuur zitten, dan is dit een onverzadigde koolwaterstof. De onderverdeling van koolwaterstoffen is nog een keertje weergegeven in figuur 1.
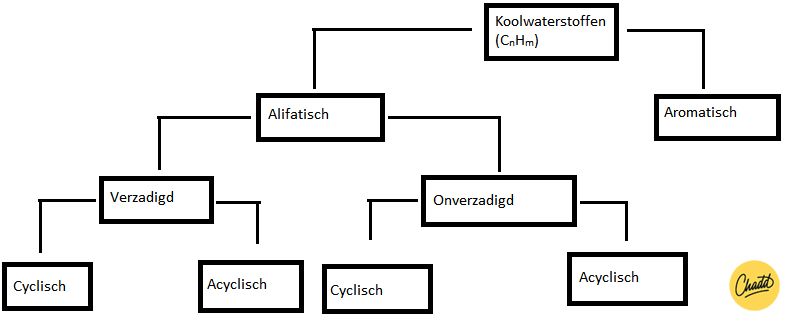
Figuur 1: stroomschema van de onderverdeling van koolwaterstoffen.
Binnen de scheikunde kennen we veel homologe reeksen, denk aan alkanen, alkenen, alkynen en cycloalkanen. Deze vier reeksen vallen binnen de alifatische koolstoffen.
| Naam homologe reeks | Algemene formule | Kenmerken |
|---|---|---|
| Alkanen | CnH2n+2 | |
| Alkenen | CnH2n | Hebben één of meer dubbele bindingen |
| Alkynen | CnH2n-1 | Hebben één of meer driedubbele bindingen |
| Cycloalkanen | CnH2n | De C-atomen vormen een ring |
Een koolwaterstof valt onder de aromatische koolwaterstoffen als het een benzeenring bevat. Benzeen (C6H6) is een cyclische koolwaterstof en heeft 3 dubbele bindingen die afgewisseld worden door een enkele binding (Figuur 2). Benzeen blijkt alleen zo opgebouwd te zijn dat elke koolstof-koolstofbinding een soort gemiddelde heeft van een enkele en een dubbele binding. Het vertoont eigenschappen van beide soort bindingen. Daardoor mag je benzeen ook tekenen met een rondje in de koolstofring. Hierdoor is het geen gewone alkeen en kan het bepaalde reacties, zoals een additiereactie met broom, niet aangaan.
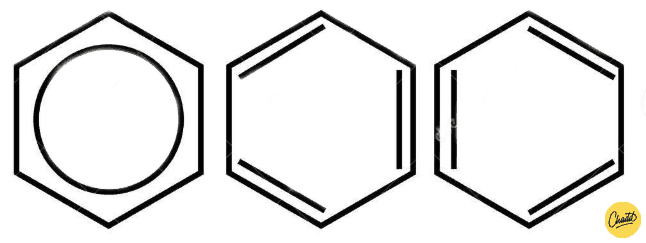
Figuur 2: verschillende notaties van benzeen
Leerlingen die hier vragen over hebben, keken ook naar:
Werkt u in het vo of mbo? Plan direct een vrijblijvende demonstratie in!
We laten u graag geheel vrijblijvend zien hoe Mr. Chadd werkt, hoe het kan worden ingezet en wat de meerwaarde is. Dit doen we in een fysieke of online afspraak van zo'n 30 minuten. Let op! Deze demonstratie is alleen bedoeld voor mensen die werkzaam zijn in het vo of mbo, NIET voor leerlingen!

Meer informatie over Mr. Chadd
Laat hieronder uw gegevens achter en we sturen u geheel vrijblijvend meer informatie over Mr. Chadd op!

Werkt u in het vo of mbo? Neem contact op!
Bent u benieuwd naar de voordelen van Mr. Chadd of heeft u andere vragen? Laat uw gegevens achter en wij nemen zo snel mogelijk contact op.

