Fasen: in welke toestanden kan een stof voorkomen en wat zijn de verschillen?
Je komt het vaak tegen bij het maken van opdrachten: fasen.
Maar wat is het nou, en wanneer zijn fasen belangrijk?

Een stof kan voorkomen in 3 fasen (of toestanden): Gas, vloeistof en vast.
Er worden afkortingen gebruikt voor de verschillende stoffen.
- Een vaste toestand geef je aan met (s), van het Engelse solid.
- De vloeibare toestand geef je aan met (l), van het Engelse liquid.
- De gasvormige toestand geef je aan met een (g).
Dus, als je ijs op een scheikundige manier wilt opschrijven, is het: water (s). Vloeibaar water is water (l), en verdampt water is water (g).
Verschillen tussen de fasen
Elke stof is opgebouwd uit moleculen. Deze moleculen gaan verbindingen met elkaar aan, en dit bepaalt de fase van de stof. De verschillen tussen de drie toestanden worden veroorzaakt door hoe de moleculen onderling met elkaar zijn verbonden.
De verschillende fases van stoffen kan je zien in figuur 1.
- In vaste stoffen zijn de moleculen stevig aan elkaar gebonden. Er is niet echt beweging mogelijk, daarom heeft de stof een eigen vorm.
- Bij vloeistoffen zijn de bindingen tussen de moleculen wat losser. Hierdoor is er wel beweging mogelijk, maar de vloeistof blijft wel bij elkaar. Vloeistof neemt de vorm aan van datgene waarin het wordt gegoten.
- In gassen zijn de bindingen tussen de moleculen erg zwak. De moleculen kunnen in alle richtingen bewegen en zullen zich ook verspreiden.
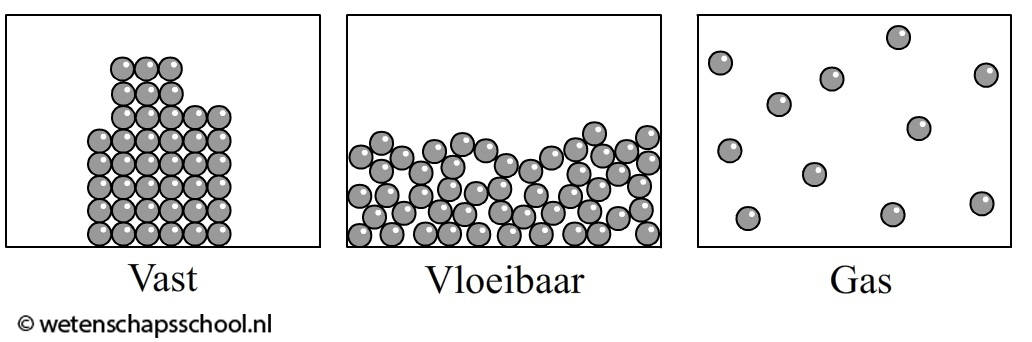
Figuur 1: Verschillende fasen van stoffen (Bron: https://www.wetenschapsschool.nl/chapter/Materiaal_2_Faseovergangen.html)
Faseovergangen
Er is voor elke faseovergang een naam. Deze zijn in figuur 2 samengevat.
De stof water is een uitzondering: de overgang van vloeibaar water naar vast water heet bevriezen.
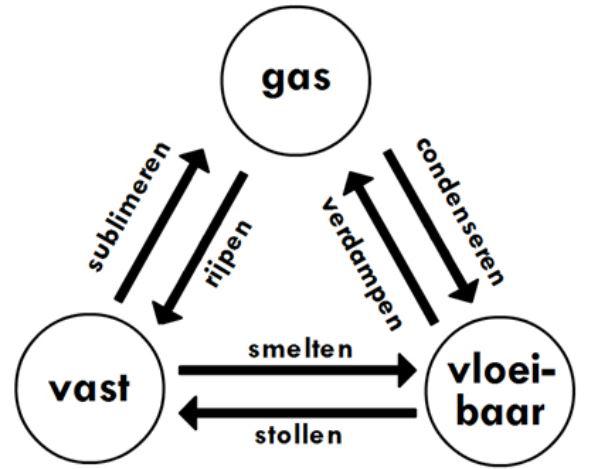
Figuur 2: Faseovergangen (Bron: https://www.wetenschapsschool.nl/chapter/Materiaal_2_Faseovergangen.html)
In welke fase een stof voorkomt hangt af van de omgeving.
Bij een lage temperatuur is een stof vast, als de temperatuur toeneemt wordt de stof vloeibaar, en als de temperatuur hoog genoeg wordt, wordt de stof een gas.
Het hangt van de stof af waar het smeltpunt en het kookpunt ligt:
Water bevriest onder de 0 ℃ (smeltpunt), is vloeibaar tussen 0 en 100 ℃ en is gasvormig boven de 100 ℃ (kookpunt).
Ijzer zie je meestal in de vaste vorm, het wordt pas vloeibaar bij een temperatuur van 1538 ℃ (smeltpunt), en het kookpunt ligt pas bij 2862 ℃.
Andere bezoekers keken ook naar: Scheikundige reactievergelijking oplossen: hoe doe je dat?
Leerlingen die hier vragen over hebben, keken ook naar:
Zo werkt Mr. Chadd
Werkt u in het vo of mbo? Plan direct een vrijblijvende demonstratie in!
We laten u graag geheel vrijblijvend zien hoe Mr. Chadd werkt, hoe het kan worden ingezet en wat de meerwaarde is. Dit doen we in een fysieke of online afspraak van zo'n 30 minuten. Let op! Deze demonstratie is alleen bedoeld voor mensen die werkzaam zijn in het vo of mbo, NIET voor leerlingen!

Meer informatie over Mr. Chadd
Laat hieronder uw gegevens achter en we sturen u geheel vrijblijvend meer informatie over Mr. Chadd op!

Werkt u in het vo of mbo? Neem contact op!
Bent u benieuwd naar de voordelen van Mr. Chadd of heeft u andere vragen? Laat uw gegevens achter en wij nemen zo snel mogelijk contact op.


