Rekenen aan evenwichtsreacties
Een evenwichtsreactie is een reactie die twee kanten op werkt.
Zulke reacties eindigen niet, zoals bij verbranding wel gebeurt, maar blijven reageren.
Na een bepaalde tijd bereiken deze reacties een bepaald evenwicht, waarin de concentraties van de stoffen constant blijven. Omdat niet alle beginstoffen worden omgezet, kan je hier niet zomaar aan rekenen. Je moet gebruik maken van onderstaand stappenplan:
- Stel de evenwichtsvoorwaarde op.
Onthoud dat bij een vergelijking als a
A+b B ⇄c C+d D
een evenwichtsconstante hoort van
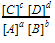 , en dat alleen gas- en opgeloste deeltjes mee moeten worden genomen. 2. Zoek de evenwichtsconstante op in de tekst, of in tabel 51 voor gasreacties, of in tabel 47 voor dissociatie van ionen. 3. Stel een BOE-tabel op. Vul bij Begin de beginconcentraties in. Let op, het gaat om concentraties! Bereken dus eerst de concentraties in mol/L. 4. Vul de andere vakjes in door middel van ‘x-stellen’. Vul bij de concentratie die je wilt weten x in. De andere vakjes kan je dan invullen door middel van de verhouding van de coëfficiënten. 5. Vul de evenwichtsconstante in met de gegevens uit de BOE-tabel. 6. Reken zelf, of met behulp van de (grafische) rekenmachine, de waarde voor x uit. Vaak moet je de ABC-formule gebruiken. 7. Geef een conclusie. Let op, als je meerdere x’en krijgt, kies dan altijd de positieve x.
, en dat alleen gas- en opgeloste deeltjes mee moeten worden genomen. 2. Zoek de evenwichtsconstante op in de tekst, of in tabel 51 voor gasreacties, of in tabel 47 voor dissociatie van ionen. 3. Stel een BOE-tabel op. Vul bij Begin de beginconcentraties in. Let op, het gaat om concentraties! Bereken dus eerst de concentraties in mol/L. 4. Vul de andere vakjes in door middel van ‘x-stellen’. Vul bij de concentratie die je wilt weten x in. De andere vakjes kan je dan invullen door middel van de verhouding van de coëfficiënten. 5. Vul de evenwichtsconstante in met de gegevens uit de BOE-tabel. 6. Reken zelf, of met behulp van de (grafische) rekenmachine, de waarde voor x uit. Vaak moet je de ABC-formule gebruiken. 7. Geef een conclusie. Let op, als je meerdere x’en krijgt, kies dan altijd de positieve x.
Voorbeeld
Je brengt bij een temperatuur van 750 K 0,90 mol stikstofmonoxidegas en 0,50 mol zuurstof in een reactievat van 0,75 dm3. Bereken de concentratie van de gevormde stikstofdioxide. De volgende reactie vindt plaats: 2 NO (g) + O 2 g⇄2 NO 2 (g).
- De evenwichtsconstante is gelijk aan
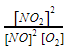 .
. - Er staat geen evenwichtsconstante in de tekst, dus je moet hem opzoeken in de Binas. In tabel 51 staan gasreacties. Bij T=750 K staat K=1,9.
Er geldt dus:
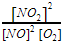 =1,9.
=1,9.
| [NO] | [O2] | [NO2] | |
|---|---|---|---|
| B | 1,2 | 0,67 | 0 |
| O | |||
| E |
- In het begin is er nog geen NO2 gevormd, hier kan je dus 0 invullen. De andere concentraties moeten eerst berekend worden. Concentraties bereken je door het aantal mol te delen door het volume in liter (of dm3 ). Voor NO is dit dus 0,90 / 0,75 = 1,2 mol/L, en voor O2 is dit 0,50 / 0,75 = 0,67 mol/L.
| [NO] | [O2] | [NO2] | |
| B | 1,2 | 0,67 | 0 |
| O | -x | -0,5x | +x |
| E | 1,2-x | 0,67-0,5x | x |
- Bij ‘Eind’ bij [NO2] kan je x invullen. Dit is de concentratie die je wilt berekenen. In de reactie staat er een coëfficiënt 2 voor NO2. Dit betekent dat als er een coëfficiënt van 2 is, er x bij komt, of af gaat. Staat er dus een 1 voor (de helft), dan komt er ook de helft bij of af, dus 0,5x. Dit kan je invullen in de tabel.De eindconcentraties kan je invullen in de evenwichtsvoorwaarde:
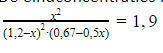 \
\ - Deze vergelijking is niet op te lossen met de hand en je hebt dus de GR nodig. Je komt uit op x=0,56. \
- De eindconcentratie NO2 is dus 0,56 mol/L. Dit komt overeen met 0,42 mol.
Opgaven
- Je brengt bij een temperatuur van 1000 K 0,80 mol zwaveldioxide en 0,45 mol zuurstof in een reactievat van 0,80 dm3. Bereken de concentratie van de gevormde zwaveltrioxide. De volgende reactie vindt plaats: 2 SO2(g) + O2 (g) ⇄ 2 SO3(g). Zie T51.
- De volgende reactie vindt plaats in water: HgI42- (aq) ⇄HgI2 (s) + 2 I– (aq). De beginconcentratie HgI42- (aq) is 3,4 M. Bereken de eindconcentratie I- (aq) in μmol/L .
Heb je nog moeite met het rekenen aan evenwichtsreacties? De slimme coaches van Mr. Chadd staan klaar om te zorgen dat je het helemaal snapt!
Werkt u in het vo of mbo? Plan direct een vrijblijvende demonstratie in!
We laten u graag geheel vrijblijvend zien hoe Mr. Chadd werkt, hoe het kan worden ingezet en wat de meerwaarde is. Dit doen we in een fysieke of online afspraak van zo'n 30 minuten. Let op! Deze demonstratie is alleen bedoeld voor mensen die werkzaam zijn in het vo of mbo, NIET voor leerlingen!

Meer informatie over Mr. Chadd
Laat hieronder uw gegevens achter en we sturen u geheel vrijblijvend meer informatie over Mr. Chadd op!

Werkt u in het vo of mbo? Neem contact op!
Bent u benieuwd naar de voordelen van Mr. Chadd of heeft u andere vragen? Laat uw gegevens achter en wij nemen zo snel mogelijk contact op.

