Lewisstructuren
De ruimtelijke bouw van een molecuul wordt bepaald door de valentie-elektronen van de verschillende atomen.
Dat zijn de elektronen in de buitenste schil van het atoom.
Als je in een structuurformule van een molecuul alle valentie-elektronen tekent, krijg je de bijbehorende lewisstructuur.
Bij het opstellen van de lewisstructuur geldt de octetregel. Dat houdt in dat elk atoom in een molecuul streeft naar een edelgasconfiguratie, oftewel acht valentie-elektronen. Een uitzondering hiervan is het H-atoom, deze wil altijd twee valentie-elektronen hebben. Het gemeenschappelijke elektronenpaar van een atoombinding (het bindende elektronenpaar) geef je weer met een streepje. Dat is gewoon het bindingsstreepje die je altijd tekent in structuurformules tussen de atomen. Alle andere valentie-elektronen (de vrije elektronenparen) teken je met stipjes in groepjes van 2. Elk stipje stelt een elektron voor. Hieronder zie je enkele voorbeelden van lewisstructuren:

Het opstellen van een lewisstructuur
Het bepalen van de hoeveelheid gemeenschappelijke en aantal vrije-elektronenparen kan je het best doen via onderstaande tabel:
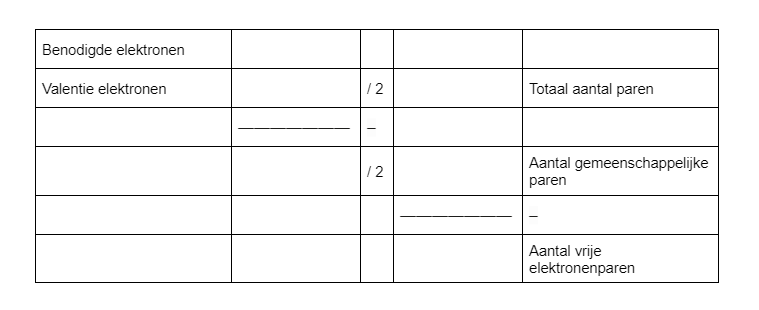
Linksboven vul je het aantal benodigde elektronen in. Je maakt hier gebruik van de octetregel. H-atomen willen 2 valentie-elektronen, andere atomen willen er 8. Je telt dit bij elkaar op. Vervolgens bepaal je het aantal valentie-elektronen. Deze kan je vinden in het periodiek systeem. Door te kijken naar de positie van een atoom in het periodiek systeem kan je de hoeveelheid bepalen van de valentie-elektronen. De atomen uit groep 1 van het periodiek systeem hebben allemaal één valentie-elektron en alle atomen uit groep 2 twee valentie-elektronen. De atomen uit groep 13 hebben allemaal drie valentie-elektronen. Als je het aantal valentie-elektronen hebt gevonden per atoom tel je deze bij elkaar op. Vervolgens moet je enkele berekeningen uitvoeren. Je deelt het aantal valentie-elektronen door twee en vult dit in. Dit zijn het totaal aantal paren dat je moet tekenen. Vervolgens haal je het aantal valentie elektronen af van de benodigde elektronen en deel je dit door twee. Dit is het aantal gemeenschappelijke paren, oftewel, bindingen. Vervolgens haal je het aantal gemeenschappelijke paren af van het totaal aantal paren en kom je uit op het aantal vrije elektronenparen.
Vervolgens moet je deze tekenen.
Een voorbeeld: H2O.
De tabel komt er dan als volgt eruit te zien:
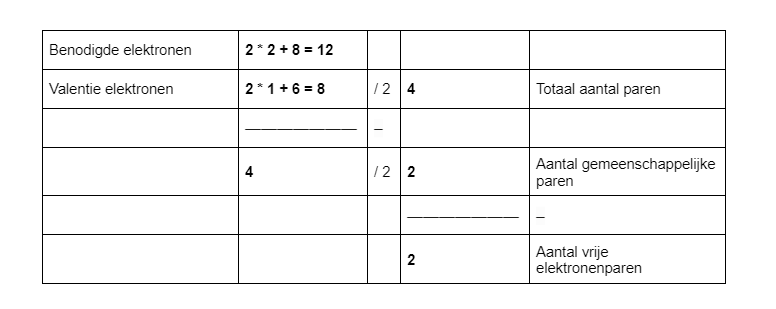
H2O wil 12 elektronen hebben. O wil er namelijk 8 en elk H-atoom wil er 2. Het aantal valentie-elektronen kan je vinden in het periodiek systeem. Nu kan je alle berekeningen uitvoeren. Je komt uit op twee gemeenschappelijke elektronenparen en twee vrije paren.
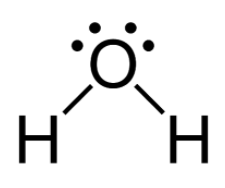
Nu kan je deze in de structuurformule zetten. De twee bindingen zitten tussen de O en de H. Waar moeten dan nog elektronen bij? Volgens de octetregel heeft elk H-atoom er nu 2. Een binding telt tenslotte als 2 elektronen. O heeft er 4, maar wil er 8. Daar moeten dus nog 4 elektronen bij, dat zijn precies de twee vrije elektronenparen. Zie onderstaande afbeelding.
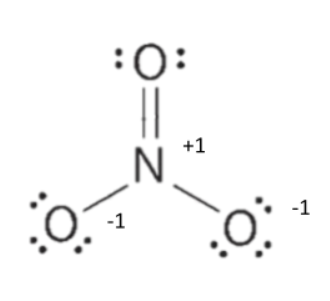
Voorbeeld: NO3–.
Bij dit voorbeeld heb je te maken met een negatieve lading. De negatieve lading komt door een elektron extra. Je moet daarom bij een negatieve lading een elektron extra rekenen bij de valentie elektronen. Was dit een positieve lading geweest, dan moest je een elektron van de valentie-elektronen afhalen.
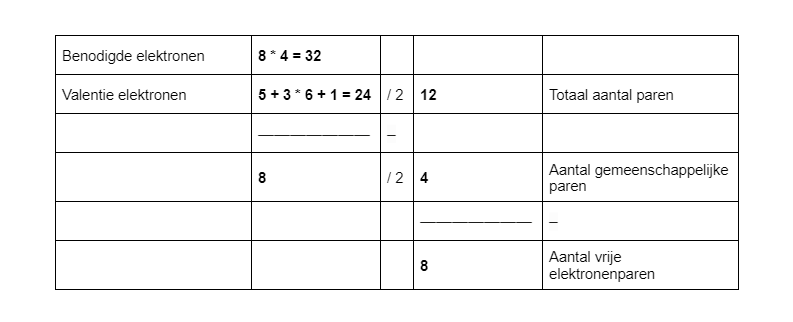
NO3-wil 32 elektronen hebben. N wil er namelijk 8, en de drie O-atomen willen er elk ook 8. Het aantal valentie-elektronen kan je vinden in het periodiek systeem, en je moet er 1 bij optellen, omdat het een -1 lading heeft. Je komt uit op 4 gemeenschappelijke paren en 8 vrije elektronenparen.
Je begint met de vier bindende elektronenparen. Je krijgt één dubbelgebonden O aan een N, en twee enkel gebonden O’s aan de N. Vervolgens kan je de vrij elektronenparen aanvullen, totdat elk O- en N-atoom voldoet aan de octetregel. N Heeft al vier bindingen (8 elektronen) om zich heen, dus die hoeft er geen vrije meer bij. De enkel gebonden O’s moeten er elk nog 3 paar bij, de dubbelgebonden O moet er nog 2.
Echter, nu ben je nog niet helemaal klaar. Het ion heeft tenslotte een lading van -1, en dat zie je nu nergens terug. Bij elk atoom moet je nu kijken welke lading het heeft. De dubbelgebonden O heeft 6 elektronen direct om hem heen (2*2 vrije elektronen en 2 van de bindende (hierbij telt een bindend elektronenpaar als 1 elektron)). Hier heeft normaal ook 6 valentie-elektronen, dus dat klopt. De enkel gebonden O’s hebben echter 7 elektronen om zich heen. Dit is er één te veel. Daarom krijgen beide een negatieve lading. N heeft er 4, terwijl het een valentie heeft van 5. Dat is er dus 1 te weinig, dus krijg het een positieve lading. De totale lading is dan -1.
Ruimtelijke structuur bepalen
Als je de lewisstructuur bepaald hebt kan je ook de ruimtelijke structuur bepalen. Dit doe je door middel van de VSEPR-techniek. Je kijkt naar het centrale atoom. Daarvan moet je het omringingsgetal afleiden. Dit zijn atomen die verbonden zijn plus het aantal vrije elektronenparen. Bij H2O is O het centrale atoom, en heeft een omringingsgetal van 4. Bij NO3– is N het centrale atoom met een omringingsgetal van 3.
De bijbehorende structuur is dan:
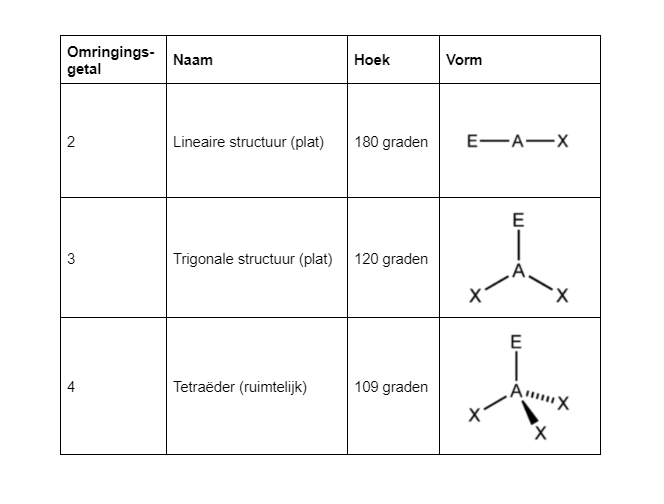
Water heeft dus een tetraëdrische vorm met als centrale atoom een H, en op de hoekpunten twee keer een H, en twee keer een vrij elektronenpaar. Het nitraation is dus trigonaal plat, en heeft op elk hoekpunt een O.
Dipool
Nu je de ruimtelijke structuur van moleculen kan bepalen, kun je ook voorspellen of een molecuul een dipool is of niet. Een molecuul is een dipool als de ene kant van het molecuul een andere lading heeft dan de andere kant. Neem bijvoorbeeld water. De onderkant (de kant met de H’s) is redelijk positief geladen, de bovenkant (het O’tje) is redelijk negatief geladen. Er is dus sprake van een dipool. CO2 is bijvoorbeeld geen dipool. Dit is namelijk een lineair molecuul (omringingsgetal 2). De O’s zijn redelijk negatief, de C positief. Echter, er is geen sprake van een dipool, omdat in de ruimtelijke structuur geen plus en min kant is. De buitenkant is min en de binnenkant plus, maar je kan dus niet spreken over een boven- en onderkant. Daarom heb je dus de ruimtelijke structuur nodig om te bepalen of een molecuul dipool is.
Oefenvragen
- Bepaal de ruimtelijke structuur van NH3. Geef daarvoor eerst de lewisstructuur.
- Is NH3 een dipool-molecuul?
Heb je nog meer vragen over lewisstructuren, VSEPR, dipolen of over iets anders? Stel ze dan gerust aan onze coaches bij Mr. Chadd!
Werkt u in het vo of mbo? Plan direct een vrijblijvende demonstratie in!
We laten u graag geheel vrijblijvend zien hoe Mr. Chadd werkt, hoe het kan worden ingezet en wat de meerwaarde is. Dit doen we in een fysieke of online afspraak van zo'n 30 minuten. Let op! Deze demonstratie is alleen bedoeld voor mensen die werkzaam zijn in het vo of mbo, NIET voor leerlingen!

Meer informatie over Mr. Chadd
Laat hieronder uw gegevens achter en we sturen u geheel vrijblijvend meer informatie over Mr. Chadd op!

Werkt u in het vo of mbo? Neem contact op!
Bent u benieuwd naar de voordelen van Mr. Chadd of heeft u andere vragen? Laat uw gegevens achter en wij nemen zo snel mogelijk contact op.

